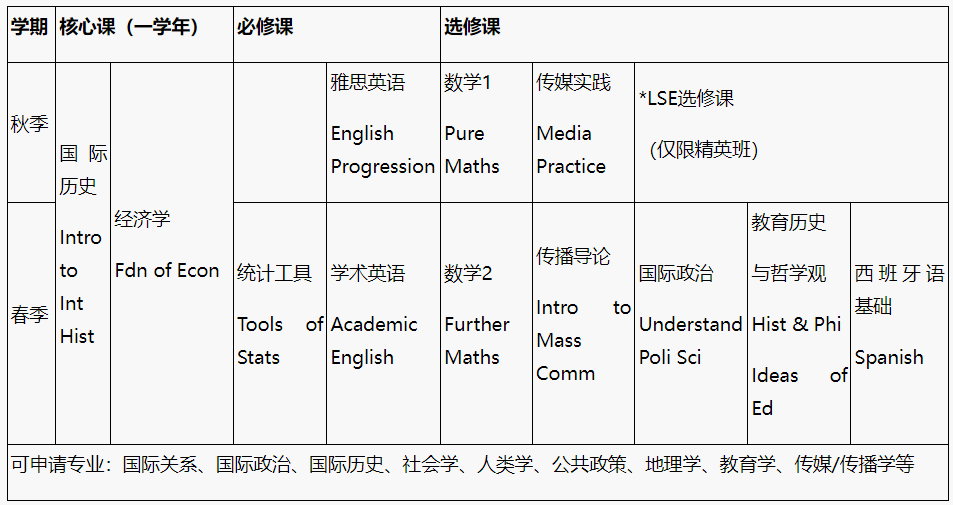
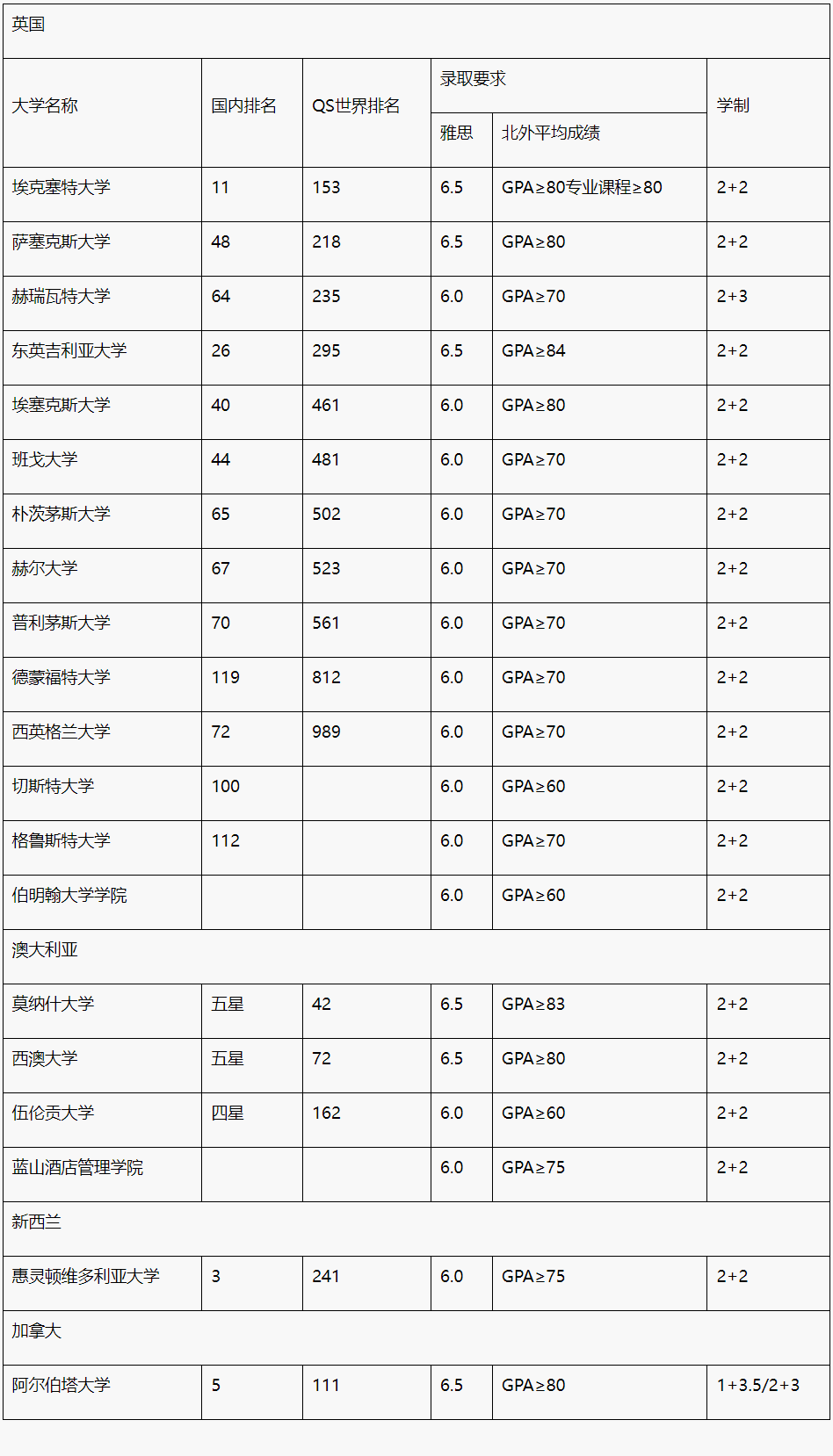
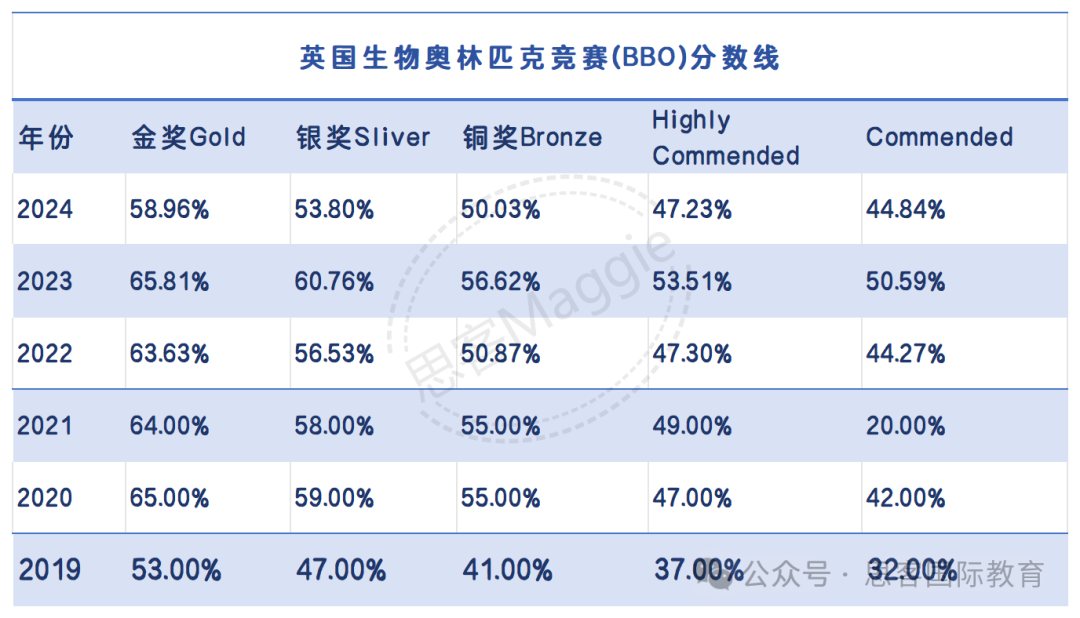
前言[了解一下背景,知道我吹的啥]
[我研究的东西对人生活有用]
有机叠氮化合物是许多药物分子、含能材料和化学探针的重要组成部分。它们还是合成天然产物、药物分子和农用化学品的重要砌块。
[我研究的东西在科研上有用]
另外叠氮化物广泛应用于经典有机方法学中,如Staudinger还原和连接反应、Huisgen环加成、点击反应、Schmidt反应以及aza-Wittig反应。最近,叠氮化合物在过渡金属催化C-H胺化反应中被用作氮宾前体。尤其是在多步合成中,R-N3可当作受保护的胺。
[让开,我要吹牛皮了]
这里,我们报道第一例铁和光介导的、未活化烯烃的反马氏氢叠氮化反应。
[大家看看牛皮在哪]
该转化使用NaN3作为性质稳定的叠氮源,反应对空气和湿度不敏感,并且可以在温和条件下进行,这也使得该反应有很好的官能团兼容性。

[有机方法学创新很重要,我研究的东西有意义]
有机叠氮化合物在合成化学与生物学中广泛应用,这使得通过易获得原料直接生成该类化合物的方法学创新非常有必要。
[以前大家用的啥方法]
传统方法学中,有机叠氮化合物通过亲核取代以及重氮和叠氮转移反应合成。作为补充方法,直接利用烯烃转化为烷基叠氮也已得到了研究。早期Hassner和Kropp的研究集中在将HN3加成到烯烃上,从而可得到相应的马氏加成产物。
[我们在这个领域还是很牛皮的,顺便引一下自己组的论文]
我们利用钴催化剂、硅烷和TsN3的组合,已经开发了一种更温和、适应性更好的条件来实现非活化烯烃马氏氢叠氮化的方法。
[别人的工作]
随后Boger揭示马氏氢叠氮化可能是通过铁氢(Fe-H)中间体进行。
[反马氏选择性的工作]
为得到反马氏加成产物,往往需要进行多步反应。直到最近,对于双键直接的反马氏叠氮化才被报道。Chiba和Gagosz研究了一种高价碘试剂(azidobenziodoxolone,ABX)用于高烯丙基苯醚的氢叠氮化,后者在反应中作为分子内氢原子给体。
于炜及其同事报道了利用Ir光催化剂和TMSN3实现不饱和芳基酰胺氢叠氮化反应。最近Xu和刘国生课题组分别从TMSN3和benziodoxolone中原位生成高价碘试剂ABX以实现反马氏氢叠氮化。
[前人的工作不行,还是我们牛皮]
尽管取得了这些重要进展,但仍缺乏使用NaN3作为现成且廉价的叠氮源的简便方法。

[写论文就是一个吹牛皮的过程,懂的都懂。这个过程主要集中在引言部分,以上内容采用原文中的视角(斜体加粗是解读,其它为原文对应翻译)。但以下内容由于相对客观,故用第三人称解读。]
/二/条件优化
可见光激发过渡金属(如CuII, TiIV和FeIII)盐能引发配体到金属电荷转移(ligand-to-metal charge transfer, LMCT)过程,可实现二氯化、二叠氮化或Giese 反应。基于此认知以及作为最丰富过渡金属的铁,其配合物能在蓝光照射下产生自由基,作者设想或许铁盐可用于烯烃的氢叠氮化反应中,并以温和具有选择性的方式进行。
作者筛选了不同的条件参数包括铁盐,溶剂(注意!安全隐患:叠氮可以取代二氯甲烷中的氯,而生成极易爆炸的中间体,所以在使用叠氮时一定尽量避免使用二氯甲烷作为溶剂)以及光源等。
他们发现当使用FeCl3• 6H2O作为金属盐,PhCF3为反应溶剂,在0 °C条件下蓝光照射16小时,目标分子产率可达83%。需要指出的是,当该反应使用无水FeCl3时,仅得到痕量的产率。

/三/底物拓展
在得到最优条件后,作者对底物范围进行了考察。结果表明含有不同官能团的单、二、三、四取代烯烃都能顺利生成目标叠氮化合物,如卤素、氰基、羟基、氨基、三氟甲基等基团均可兼容该反应。

/四/应用
该反应还可以应用到后期官能团化中,许多药物活性分子和天然产物表现出了很好的兼容性。

此外,为了避免后处理、溶剂蒸发、纯化、分离和叠氮中间体的处理,作者还进行了一锅法合成。如使用“一锅两步”实现了点击反应和氢胺化反应。

/五/机理研究
为了深入探究该反应机理,作者还进行了以下实验。
A. 自由基捕捉实验:未检测到目标产物,说明该反应过程涉及自由基中间体。
B. 醛的1,5-氢原子攫取反应:得到脱羰基产物,说明烯烃生成了二级碳自由基,随后从醛中通过1,5-氢自由基攫取获得氢原子,并经历脱碳基生成更稳定的三级自由基,而后被淬灭。
C. 5-exo-trig环化反应:仅得到环化产物,表明淬灭要慢于环化过程。
D. 氘代实验:在其它条件不变下,铁盐替换为无水FeCl3,并以水为添加剂。当使用H2O时可以得到77%的产率,但当用D2O仅得到18%的产率。该结果表明,水是终端氢源,并且二级碳自由基最后的氢原子转移过程很可能是决速步。

提出的机理
基于前人的工作以及以上探究实验,作者提出以下机理。即三价铁与叠氮阴离子通过配体交换给出Fe-N3物种,其在蓝光照射下通过LMCT过程产生二价铁以及叠氮自由基。随后烯烃与该自由基进行自由基加成得到二级烷基自由基,再经过淬灭(氢原子转移)生成最终产物。

/六/总结
瑞士苏黎世联邦理工学院(ETH Zürich)、JACS主编Erick M. Carreira课题组发展了FeCl3• 6H2O和光介导的、非活化烯烃的反马氏氢叠氮化反应。该反应利用廉价易得且性质稳定的NaN3作为叠氮源,对空气和湿度不敏感,并有着广泛的底物适用性和官能团兼容性。该反应还能应用到许多复杂分子的后期修饰中,为合成各种有机叠氮化合物提供了简单而实用的新方法。
/七/评论
评论者:
@读者C:该工作利用廉价易得且性质稳定的NaN3作为氮源,实现了一系列含不同官能团烯烃以及复杂分子的叠氮化,为叠氮化合物的合成提供了一种实用和高效的新方法。
@读者H:就这!要放在我们课题组,压根就发不了JACS。
@读者E:在我看来,这更像是技术创新而非科学。
@读者M:看来有机方法学发文章更重视应用了,是不是基础创新逐渐乏力了呀。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.3c09122