文献分享
Toehold Switch
De-Novo-Designed Regulators of Gene Expression
Alexander.A Green et al., Cell, 2014
合成生物学领域的研究人员们正面临着设计和构建新型生物元件的巨大挑战。传统的基因调控器件往往受限于动态范围低、串扰高等问题,这极大限制了复杂基因网络的构建。针对这一难题,哈佛大学等机构的科学家们创新性地设计了一种名为Toehold开关的新型RNA调控器。
与传统调控器不同,Toehold开关通过与特定触发RNA的线性-线性交互来激活基因表达,展现出超高的动态范围和极低的串扰。这一突破性设计为合成生物学提供了强大的新工具,有望在分子生物学和生物技术领域带来广泛应用。
1、第一代Toehold Switch及其功能验证

Figure 1. 传统核糖体调节器

Figure 2. Toehold Switch
相对于之前的RNA开关,第一代“脚趾开关”做了如下改变:
第一代“脚趾开关”通过在起始密码子(AUG)前后编程的碱基对抑制翻译,使RBS和起始密码子区域完全不配对。且在“发卡”结构前加入了一段“脚趾”序列a,“发卡”结构后通过Linker将“脚趾开关”与目的RNA序列连接起来。
当触发RNA里的序列a*和“脚趾”序列a互补配对时,“发卡”结构被打开,RBS序列及起始密码子AUG暴露出来使RNA得以翻译。


Figure 3-4. 表达强度验证
Figure 3是与大肠杆菌自身荧光和阳性对照相比,支点开关的流式细胞术GFP荧光直方图。Autofluorescence组为不含GFP表达质粒的诱导细胞的自身荧光水平;Figure 4是与阳性对照结构和自身荧光相比,开关在ON和OFF状态下测量的GFP模式荧光水平。
结果显示,当“脚趾”开关在加入触发RNA时大肠杆菌表达的荧光强度与阳性对照组相近,而“脚趾”开关在不加入触发RNA时大肠杆菌表达的荧光强度与大肠杆菌自身荧光水平相近,说明第一代“脚趾”开关有一定的调控能力。同时发现在“脚趾”开关在不加入触发RNA时存在少量荧光蛋白泄露表达现象。
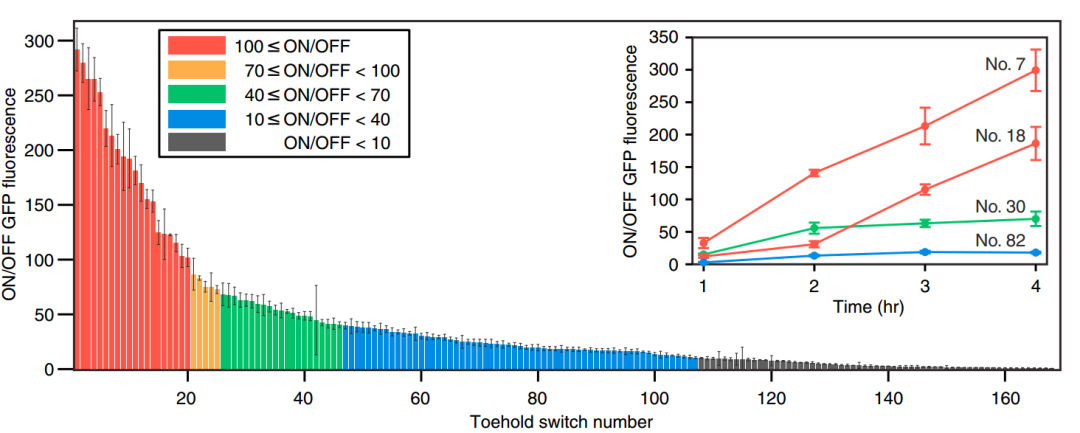
Figure 5. 第一代Toehold Switch On/Off
由图知1至20的脚趾开光的工作性能较好,ON/OFF在100以上,而也存在部分开关工作性能较低,ON/OFF在10以下。同时部分开关的工作性能与时间有关,时间过程测量显示,系统在诱导1小时内激活,并且随着GFP的持续产生,开/关比率随着时间的推移而增加。

Figure 6. 第一代Toehold Switch正交性验证

Figure 7.第一代Toehold Switch正交性验证
Figure 6可见同源开关和触发RNA对沿网格对角线的强荧光效果,编号26处的最终开关由于其低开/关比而显示较低的荧光。低荧光水平观察到非对角线元件具有非同源的触发/开关RNA对。实验说明第一代“脚趾”开关有较强的正交性。
Figure 7通过将非同源触发器和给定开关RNA获得的GFP荧光除以开关在触发状态下的荧光来计算串扰。测试的全套26个开关显示的串扰小于12%,说明了脚趾开关的正交性较强。

Figure 8. 第一代Toehold Switch库正交性与其它核糖体调节器的对比
Figure 8为该库动态范围指标与“脚趾”开关的最大正交子集大小的关系,以及同许多以前的RNA开关的比较。(评估正交库性能的一个相关指标是阈值串扰水平的倒数)说明了“脚趾”开关相对于之前的RNA开关,它的正交性较强,抗干扰能力较强,调控更加准确。
2、改进后的第二代开关及其有效性验证
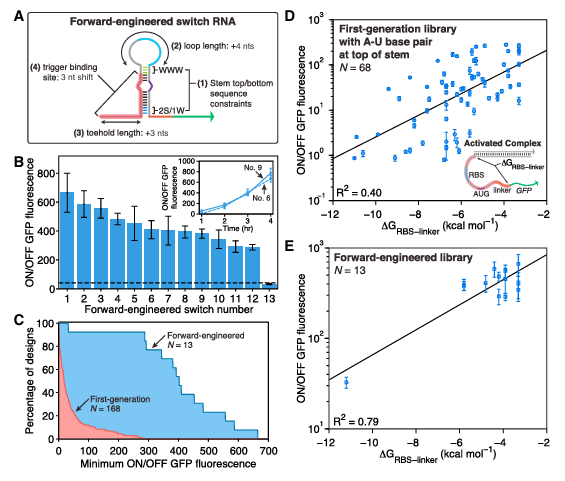
Figure 9. 改进后的第二代开关及其有效性验证
为应对mRNA的复杂二级结构对基因调控的挑战,科学家们对趾环开关进行了多项改进:他们延长了mRNA感应型趾环的脚趾结构域至24个核苷酸,以更好地穿透mRNA结构;融入了高效开关的通用序列元件来增强激活效率;设计了RNA重折叠机制降低激活能障;并利用计算工具辅助设计和筛选,确保传感器对目标RNA的高效识别。这些改进措施显著增强了趾环开关的性能和应用潜力。
通过一系列实验验证了这些改进措施的有效性:以mCherry mRNA为例,定制的趾环开关仅在其存在下激活GFP表达,证明了开关的特异性和响应性;类似地,趾环开关还能有效识别编码抗生素耐药性的mRNA;以及内源性sRNA RyhB的传感器设计,通过外加诱导剂调控RyhB表达,成功地在细胞中监测了GFP输出,进一步验证了趾环开关在复杂生理条件下的准确调控能力及其实用价值。
3、内源基因的探测及内源表达
Toehold 开关接受具有任意序列的 Trigger RNA的能力,理论上能够被激活。但与新设计的单链结构的Trigger RNA不同,mRNA中大量存在二级结构,使结合变得复杂,且同源Trigger mRNA也可能内部配对或与发夹模块下游的序列配对,可能阻碍开关的激活。
对开关检测mCherry mRNA进行实验验证。开关仅在与mCherry mRNA结合时激活GFP表达,在无mCherry mRNA时低GFP表达。

Figure 10. 验证mCherry Toehold Switch表达GFP的正交性
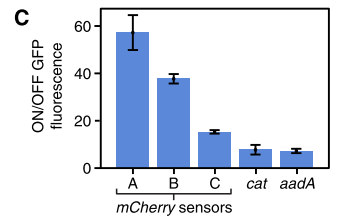
Figure 11. 三种mCherry mRNA响应开关两种用于检测抗生素耐药性的mRNA开关:cat和aadA的GFP的ON/OFF值
验证了在同源Trigger mRNA缺失或存在的情况下,三个mCherry mRNA响应开关的GFP和mCherry荧光水平。阴性对照为大肠杆菌自身荧光,而阳性对照分别来自未抑制表达的GFP和mCherry的细胞。
结果表明,仅在mCherry mRNA存在时才强烈激活GFP的表达,在没有mCherry mRNA时低GFP表达。因此脚趾开关可以检测mCherry基因表达。并且由mRNA作为Trigger RNA时,脚趾开关依然有较高的ON/OFF值。

Figure 12. Toehold Switch探测内源小RNA
对开关检测内源小RNA RyhB进行实验验证。RyhB在Fe水平低时会下调铁相关基因。用载有ryhb响应性调节GFP的脚趾开关的质粒转化细胞。
铁螯合化合物2,20-联吡啶可以快速刺激RyhB的表达,在培养基中添加该化合物诱导RyhB sRNA表达。诱导后1小时流式细胞术量化表达。可见GFP阳性对照在2,20-联吡啶浓度增加时表达减少,但加入了脚趾开关的细胞随着2,20-联吡啶浓度增加,表达稳步增加,之后趋于平稳。因此脚趾开关可以检测内源RyhB基因表达。
4、Toehold Switch多重调节及4-input 与逻辑回路
为了表现Toehold Switch全部的多重控制能力,作者在同一个细胞中表达了12个Toehold Switch,并用流式细胞术分别确认了这几个控制的活性。具体基因线路设计如下图:

Figure 13. 12个Toehold Switch的基因线路设计
(补充:GFP,venus,cerulean,mCherry为四种不同的荧光蛋白,以报告基因表达。SA-SL为不同的二代文库中的switch。以上mRNA大小约为3.4kb,T7为启动子,质粒总大小约10kb)

Figure 14. 多重调节实验结果
实验结果表明,二代Toehold Switch的正交性较好。在同时激活GFP/venus和venus/cerulean时出现明显的泄露表达,作者将 “泄露”视为GFP、venus、cerulean三个荧光蛋白光谱存在重叠导致的流式细胞术计数据的不完美补偿。实验发现非同源Trigger也可以启动泄露表达。

Figure 15. 单个荧光蛋白在不同细胞中的表达情况数据来补偿流式细胞术得到的实验数据后得到的结果(A为四种蛋白在不同细胞中的表达情况,B-E为分别为GFP、venus、cerulean、mCherry各自的不同细胞中表达情况表。F-I为补偿后的流式细胞术数据结果)
作者用三对Trigger和Switch以及两种高度正交的ECF sigma因子构建四输入的AND电路,用以验证使用Toehold构建复杂回路的可行性。
具体来说,他们用四种输入启动两组Trigger和Switch的表达,以表达出两种sigma因子,两种sigma因子再启动下游的另外一组Trigger和Switch以表达目标蛋白GFP。如下图:

Figure 16. 逻辑回路的设计
下图为实验结果,结果表明各个输入之间正交性良好。

Figure 17. 4-input 与逻辑回路实验结果









