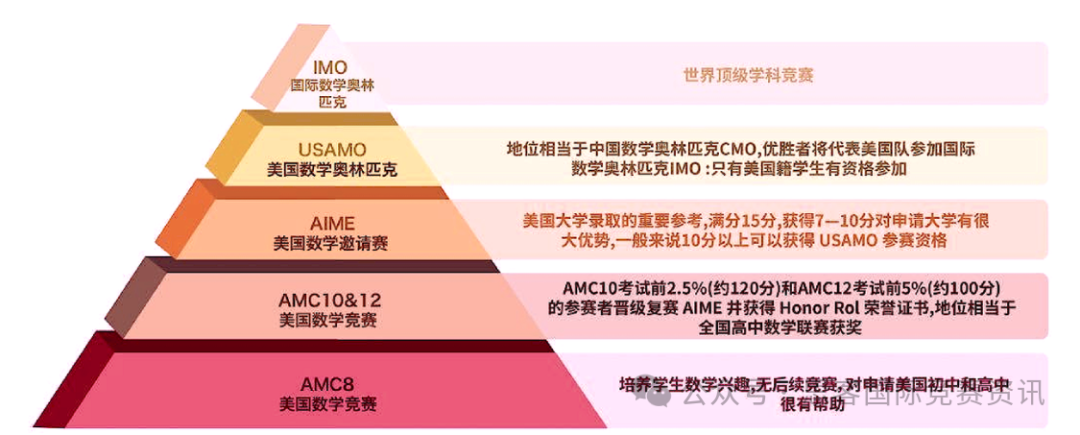
作为留学申请中具有相当含金量的化学科目,AS阶段是积累大块分值的关键时期,扎实清晰的知识脉络是稳步 A*的重中之重。其中在化学 U2的学习中,运算逻辑的繁琐和众多焓变定义的扎堆是部分考生的一大难点,本篇将由理综教研部老师结合高频出现的焓变运算技巧与易错点,为大家分享攻克这一重要章节的方法和策略。
焓变专题
攻分精讲
『量热实验』
此部分对应课本 6C、6D两小节内容,分别考察燃烧焓与中和焓的实验测算,分别对应教材 154面与 156面。
来源:燃烧焓实验测算(左),中和焓实验测算(右)
不管考察哪一种,计算思路都是三步走:
第二步,计算摩尔数n
在燃烧焓的测算实验中,实验逻辑是以燃烧释放的热量使水升温,以水的温度变化来估算燃烧过程中产生的热量,因此在用 Q=mcΔT计算热量时,注意 m、c、ΔT指向的对象均为水,分别指水的质量、水的比热容,以及水的温度变化。其中,质量 m可通过 m=ρV来进行计算 (水的密度为  )。
)。
而在中和焓的测算实验中,实验逻辑是以酸碱中和反应释放的热量使溶液升温,以溶液的温度变化来估算中和过程中释放的热量。此处的溶液为酸、碱混合溶液,因此在用 Q=mcΔT计算热量时,m、c、ΔT指向的对象则为酸碱混合溶液。出于计算方便,可将其近似为水,密度 ρ、比热容 c均取水的数值即可,如: 。
。
第二步摩尔数的计算,可结合焓变概念来确认计算对应物质的摩尔数。在燃烧焓的测算中,指的是 Spirit Burner中燃烧物质的摩尔数,一般用公式 来进行计算;在中和焓的测算中,指的是生成的液态水的摩尔数,
来进行计算;在中和焓的测算中,指的是生成的液态水的摩尔数, 。
。
在第三步的计算中,需要特别注意,公式前的负号不要遗漏。部分考生运算结果的数值是正确的,但正负号弄反了,就是因为遗漏了该公式中的负号;也有部分考生是因为第一步中 ΔT颠倒了正负号,千万注意 ,后减前,并不是单纯大的数值减去小的数值。
,后减前,并不是单纯大的数值减去小的数值。
来源:模拟作答中考生运算结果负号遗漏
*延伸知识点:量热实验中的误差分析
1、燃烧焓的误差原因分析:
(1)heat loss to surroundings
(2)incomplete combustion of alcohol
(3)evaporation of alcohol
2、中和焓的误差原因分析:
(1)heat loss to surroundings (最主要原因)
(2)measuring uncertainties due to the use of pipette and thermometer
(3)not stirred evenly
(4)heat capacity of the solution is not exactly 
『赫斯定律』
来源:教材 158面赫斯定义定义词条
根据赫斯定律,能量变化只与初末状态有关,与反应路径无关。换言之,若反应可分步进行,则总反应的焓变与各分步反应焓变的总和相等。
来源:理综教研部内部整合焓变讲义截图
以上图为例,由 A到 B,绿色箭头表示直接路径,蓝色箭头表示间接路径,两条路径的焓变值一致,满足: 。对于一些反应进程较慢、不易发生、无法直接测量焓变的反应,可通过赫斯定律来间接计算得出。
。对于一些反应进程较慢、不易发生、无法直接测量焓变的反应,可通过赫斯定律来间接计算得出。
举例说明:
来源:理综教研部内部整合焓变讲义截图
理综教研部强调在建立赫斯三角时,需将待求的目标方程写在上方,观察给定的已知焓变方程,与待求焓变的目标方程建立联系。
在 Reaction 1中,方程右侧出现的 CO,在待求目标方程的左侧也出现了,因此,如下图黄色高亮部分显示,可把 Reaction 1建入 Hess's Cycle,箭头由 Reaction 1的反应物指向生成物。把上方方程中未参与 Reaction 1反应的  照抄到下方,如图橙色高亮部分所示。
照抄到下方,如图橙色高亮部分所示。
在 Reaction 2中,反应物 C(g)、 (g)在下方,生成物
(g)在下方,生成物  (g)在上方,因此箭头方向由下到上,如图蓝色箭头所示。绿色高亮区域即表示 Reaction 2的焓变。
(g)在上方,因此箭头方向由下到上,如图蓝色箭头所示。绿色高亮区域即表示 Reaction 2的焓变。
此处需特别注意,Reaction 2中的反应物、生成物系数均为 1,而 Hess's Cycle中,是由 2mol的 C(g)、与 1mol的 (g)生成 2mol的
(g)生成 2mol的 (g),反应物、生成物前的系数均为 2,所以
(g),反应物、生成物前的系数均为 2,所以 的值需乘以 2,才是右侧蓝色箭头所示焓变值。
的值需乘以 2,才是右侧蓝色箭头所示焓变值。
至此,Hess's Cycle已建立,可将蓝色箭头表示的反应路径视为 DirectRoute,红色箭头与绿色箭头表示的反应路径视为 Indirect Route,就有:
在利用赫斯定律进行焓变运算时,理综教研部温馨提示:箭头的方向需按焓变定义由反应物指向生成物,并注意运算时是否需要乘以系数,避免不必要的计算错误。
*延伸知识点:由赫斯定律,还可延伸得到两个计算焓变的公式:
在满足条件时,直接应用公式来进行计算,更方便快捷。
『键能运算』
以键能计算反应焓,需牢记运算公式:
此类计算题难度不大,但书写中有几处细节需注意:
1)过程要分步
2)系数别漏乘
3)区分单双键
以 2021年 10月真题卷中的题目为例进行具体说明:
来源:2021年 10月化学 U2真题
首先计算Σ(bondbroken), 含有 3个 C-Hbond、1个 C-Obond和 1个 O-Hbond,
含有 3个 C-Hbond、1个 C-Obond和 1个 O-Hbond, 含有一个 O=Obond,因此:
含有一个 O=Obond,因此:
Σ(bondbroken)= 3×E(C-H) + E(C-O) + E(O-H) + 1.5×E(O=O)
= 3×413+358+464+1.5×498
同理可计算出:
Σ(bondmade)= 2×E(C=O) + 4×E(O-H) = 2×805+4×464 = 3466
最后再代入公式即可:
在前两步中,可把所有物质的 Displayed Formula画出来,更清晰地确认各化学键的数量。需注意的是, 内部的化学键为 O=O双键,
内部的化学键为 O=O双键, 包含两个 C=O双键,若题目中给了单键的键能,千万不可落入陷阱。在第二步 Σ(bondmade)的计算过程中,部分考生错把 E(C-O)的数值代入进行计算,就是因为没有区分单键和双键。
包含两个 C=O双键,若题目中给了单键的键能,千万不可落入陷阱。在第二步 Σ(bondmade)的计算过程中,部分考生错把 E(C-O)的数值代入进行计算,就是因为没有区分单键和双键。
另外,系数的漏乘也是主要错因之一。一方面要考虑方程式中化学式前的系数,另一方面,还需考虑一个分子内部是否包含多于 1个的同种化学键。此题中,化学式里  前面的系数为 2,可理解为产生 2个水分子;而每个水分子又含有 2个 O-Hbond,因此 E(O-H)前需乘系数 4。
前面的系数为 2,可理解为产生 2个水分子;而每个水分子又含有 2个 O-Hbond,因此 E(O-H)前需乘系数 4。
来源:2021年 10月化学 U2真题MarkScheme
参考阅卷标准,Σ(bondbroken)、Σ(bondmade)的分别计算各有 1分,两者相减算出 ,再得 1分。各位考生一定注意分步书写,这样即使最后一步结果出错,也能得到前面的 2分步骤分。
,再得 1分。各位考生一定注意分步书写,这样即使最后一步结果出错,也能得到前面的 2分步骤分。
*延伸知识点:用键能计算反应焓变,计算结果有误差的原因:
一方面,由键能的定义,可知键能是针对气体状态下的化学键而言的,若反应中物质不是气态,直接用键能计算就忽略了物质状态之间的能量差。
图源:教材 160面键能定义词条
另一方面,需考虑到 Mean Bond Enthalpy和 Specific Bond Enthalpy之间的差异。为方便计算,题目中提供的都是平均键能,此数值与特定分子中的某个特定键能相比,存在偏差。
因此,用键能计算得出的反应焓数值与 Databook Value有偏差的原因,可表述为以下两点:
1)Bondenthalpiesarebasedonsubstancesinthegaseousstate,butinthereaction,…isaliquid/solid
2)Bondenthalpiesareaveragedforthebondindifferentchemicalenvironment, not the actual bond enthalpies in the reaction.
以上就是理综教研部针对化学 U2中大分值考点焓变专题易错点的整合解析,涵盖踩分点与标准表述,还需反复阅读熟悉内化,助力各位在接下来的赛季中能够稳步前进,预定 A*!