Reading
文献分享——Designing Biological Circuits: Synthetic Biology Within the Operon Model and Beyond (2)
在这篇综述中,作者研究了Jacob和Monod提出的操纵子模型如何为第一代合成基因线路的构建奠定基础,并用微生物合成生物学的一系列例子来说明最广泛的合成基因调控策略与几十年前Jacob和Monod的预测之间惊人的相似性。
01、介绍
The first part
在1961年发表的一系列具有里程碑意义的论文中,Jacob和Monod将当代关于基因结构及其表达模式的发现整合为一个全面而深远的基因调控理论:操纵子模型(operon model)[1]。这个框架来自于他们自己在乳糖存在下培养的大肠杆菌中诱导β-半乳糖苷酶活性的工作,以及其他几项关于适应性酶和λ噬菌体的研究。为了解释代谢适应和分化现象,Jacob和Monod提出了模型遗传回路的蓝图。这些网络由三类遗传元件组成:调控基因(如lacI),它们的目标操作符(如lacZYAo)和结构基因(如lacZ)。
操纵子模型提出了几个可验证的预测,包括以下内容: (a) 类似的机制可能在生命的各个领域都是保守的; (b) 元件是模块化的,这意味着操作符和调节器可以与下游操作符分离; (c) 这些元件可以组成具有复杂突现行为的基因调控网络。经过几十年的研究,自然基因调控网络的这些特征得到了完善,为合成生物学领域提供了基础和灵感。
02、操纵子模型中的合成生物学
The second part
在本节中,作者讨论了操纵子模型及其更广泛的理论框架对合成生物学早期研究的广泛影响。首先强调早期合成基因回路与Jacob和Monod提出的图表之间的惊人相似性。我们讨论了转录调控策略的扩展,以涵盖操纵子模型中允许的全部行为,并注意到转录回路仍然是合成生物学中细胞重编程的主要模式。沿着中心法则,接着强调了Jacob和Monod提出的用于转录后调控的替代细胞质操作符模型与开发和实施基于RNA的工具构建合成电路之间的相似之处。
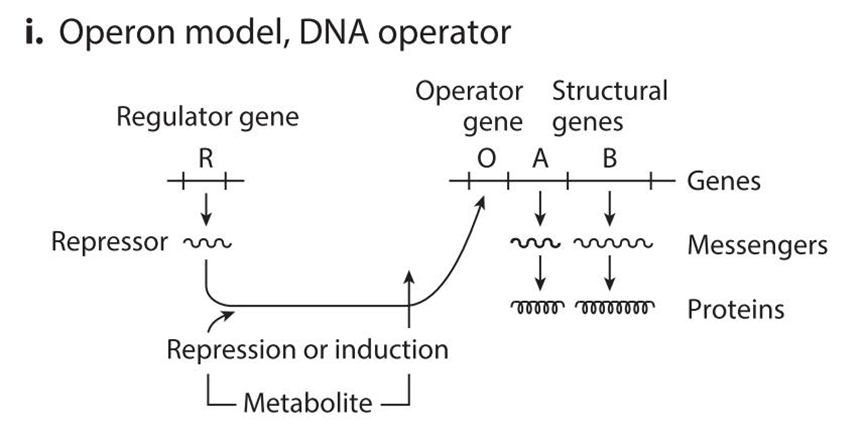
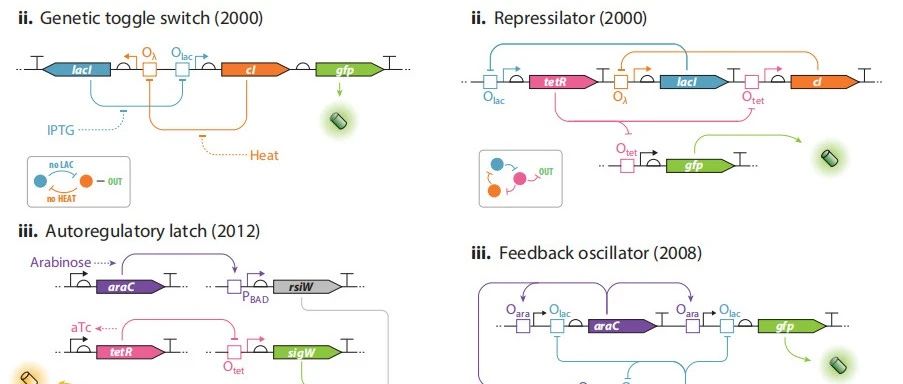
I:DNA 操纵子模型:调节基因表达产物调控下游操纵子序列,从而控制其下游基因表达,通过负控诱导的方式,即抑制蛋白在诱导物的作用下解除对于操纵子的抑制作用。
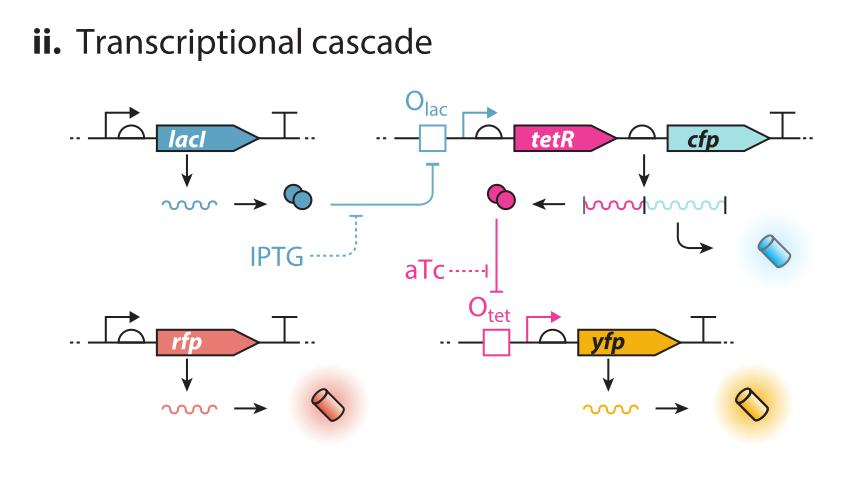
II:转录水平级联调控:LacI 在 IPTG 诱导下解除对tetR的抑制,开启其表达,tetR 在 aTc 的诱导下解除对于YFP的抑制,开启其表达。其中,组成型表达的RFP用于测量该系统的外源噪声。
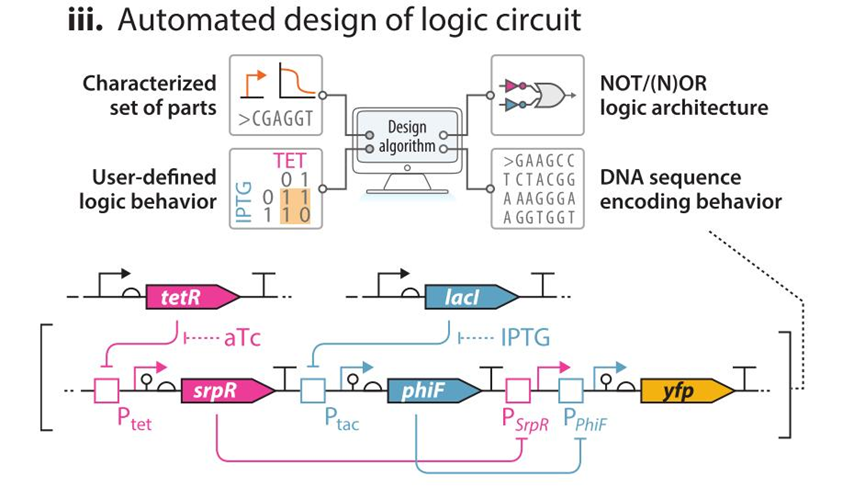
III:自设计逻辑电路:NOR 逻辑门,在 aTc 和 IPTG 的单一诱导下可开启 srpR 或 phlF 蛋白表达从而抑制下游YFP的转录。
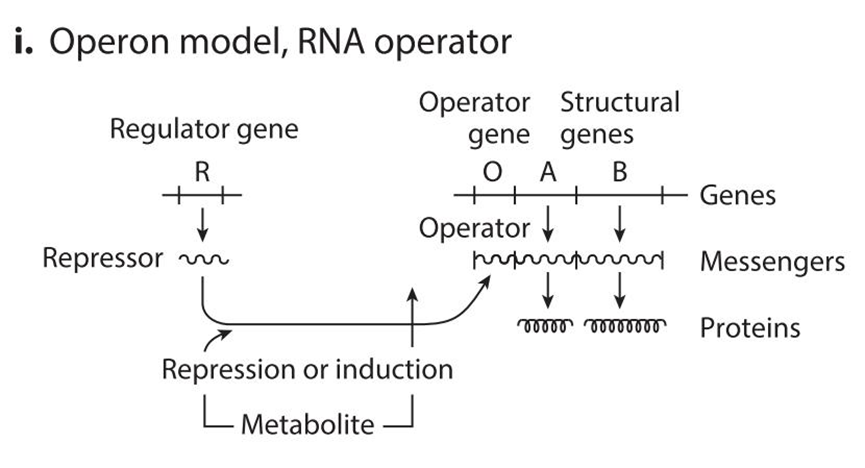
I:RNA 水平的操纵子模型:类似于 DNA 水平的操纵子,不过是在 mRNA 水平上进行调控。
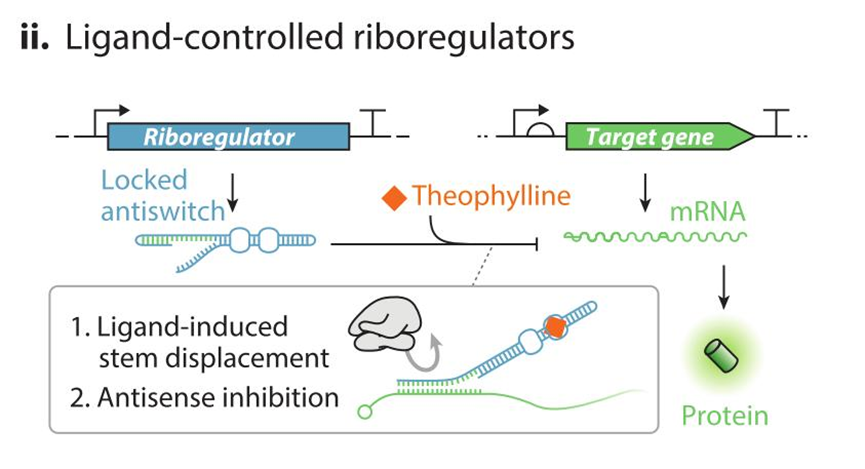
II:配体调控的核糖开关:在无茶碱配体的诱导下,核糖操纵序列会发生自身配对,无法结合到 mRNA 上。在有茶碱配体诱导的情况下,该序列构象改变,使其与自身配对的一部分暴露,并且与 mRNA 片段头部的特定部位结合,阻止 GFP 蛋白质的合成。
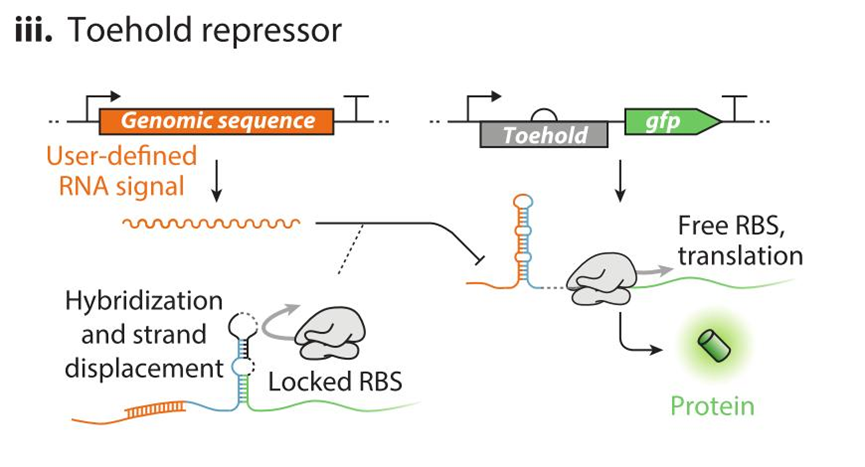
III:Toehold 抑制子“Toehold Switch”合成的 Toehold 阻遏子是一个操作序列,并且在匹配的 RNA 分子杂交时隔离 RBS,该 RNA 分子充当调节子,即 RNA 分子与 Toehold 阻遏子配对结合的时候会改变其茎环结构,使得 RBS 位点被遮蔽使得核糖体无法结合表达。
03、操纵子模型以外的合成生物学
The third part
在本节中,作者探讨了最近生命科学领域的基本进展如何为合成生物学家提供了采用新工具编程复杂表型的机会。首先强调在过去的二十年中,可编程的DNA和RNA结合分子如何介导了设计转录和转录后电路和调控器的方式的根本转变。然后,作者将重点放在植根于当代遗传调控模型的合成驱动策略上,包括表观遗传学和远程DNA相互作用。最后,作者讨论了合成生物电路组装中日益强调的翻译后调控策略。
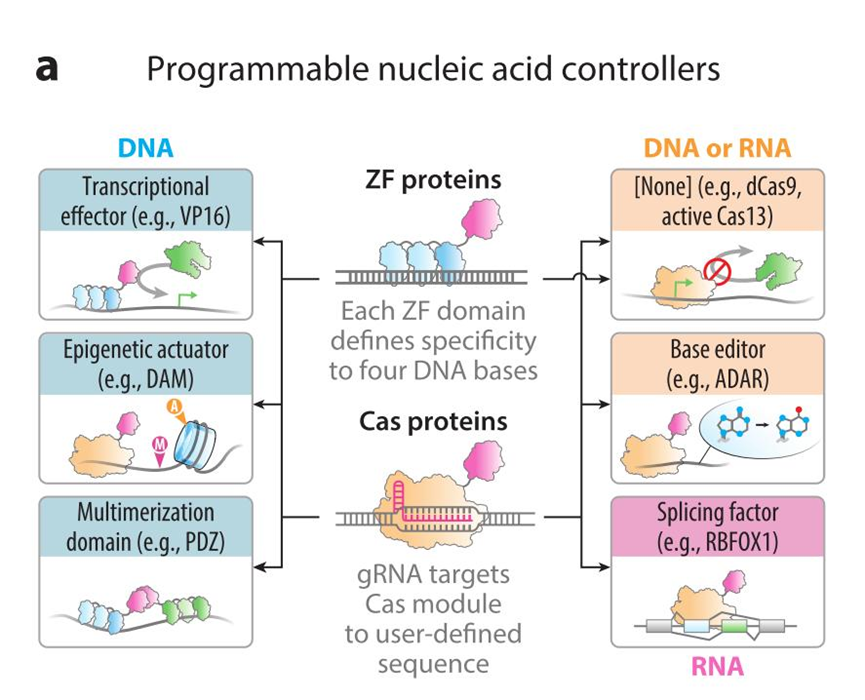
a:可编程核酸控制器:每个锌指蛋白结构域可以特异性识别结合 4 个碱基对长度的 DNA 片段,因而多聚锌指蛋白可以达到特异性识别特定序列的功能。Cas 蛋白可以在特定的gRNA 的引导下靶向结合对应序列。介于上述两者具有的特异性靶向能力,在此基础上可以加以改造以实现特异性激活转录(与 VP16 转录激活蛋白)、表观遗传修饰(与 DAM 转移酶)、协同作用的效应子的多聚化模块组装(PDZ)。RNA 靶向的 Cas/dCas 系统(dCas9、Cas13、dRNaseH1 等)可用于降解 mRNAs或作为支架将碱基编辑{ADAR (腺苷脱氨酶)参与腺苷-肌苷 RNA 编辑}和剪接因子定位到感兴趣的转录本上。
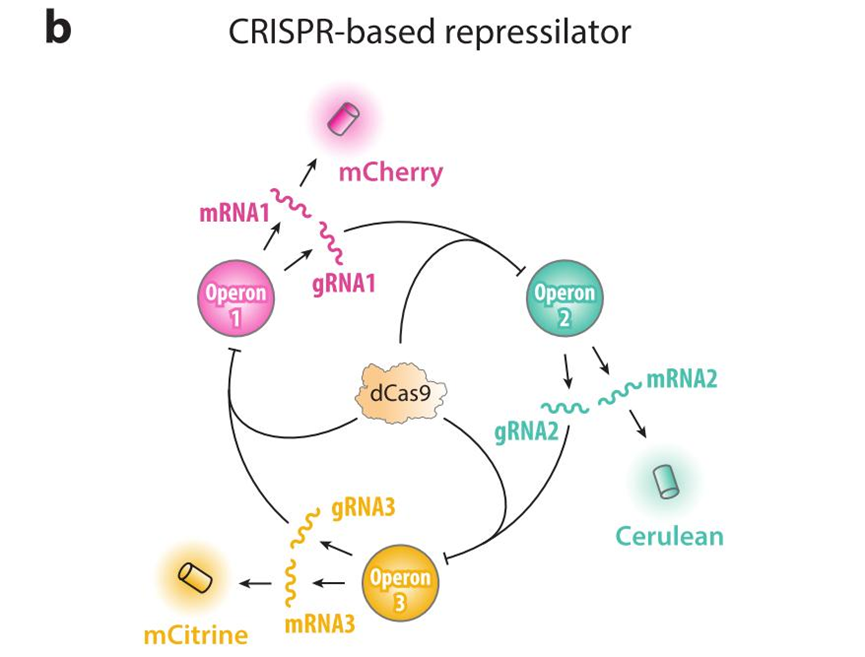
b:基于 CRISPR 的抑制振荡子:每个操纵子同时表达报告荧光蛋白和靶向下一操纵子序列的 gRNA,引导 dCas9 蛋白前往结合并抑制该操纵序列基因转录表达。操纵子 1 表达的 gRNA 引导 dCas9 靶向结合操纵子 2 序列并抑制,此时操纵子 3 开启表达抑制操纵子 1 从而逐渐减缓对操纵子 2 的抑制.....三色系统中各个组分呈现出周期性波动,在振荡中循环往复。
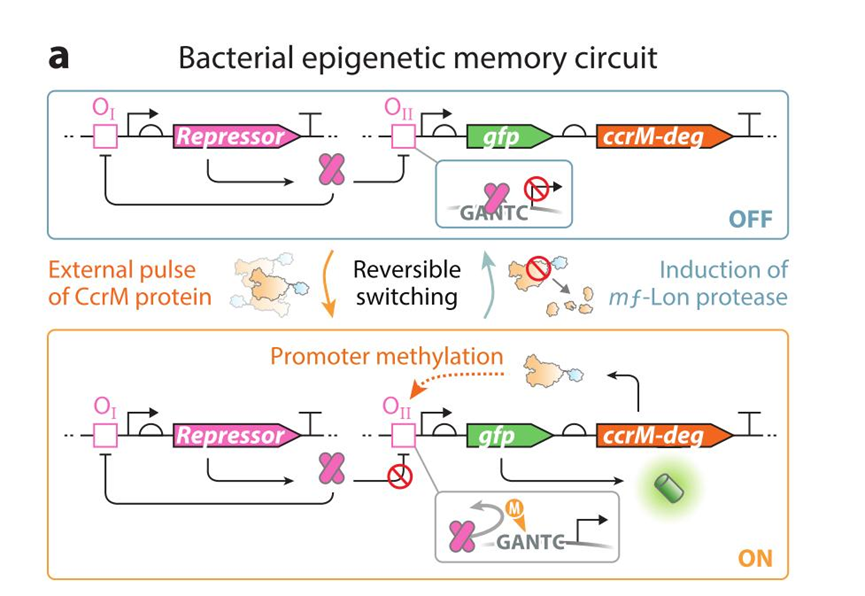
a:细菌表观遗传记忆回路:锌指阻遏蛋白为负反馈调节控制自身蛋白水平,并特异性结合到操纵子 II 抑制下游基因转录表达。当 DNA 甲基转移酶 CCRM 引入后便会甲基化操纵子 II 使得无法被阻遏蛋白抑制,开启下游报告基因gfp与CCRM-deg表达,CCRM 产生正反馈调节,不断保持操纵子 II 甲基化状态。当 MF-Lon 蛋白酶引入时便会特异性降解带有其降解标签的 CCRM-deg 从而关闭甲基化,恢复原先被阻遏的状态。
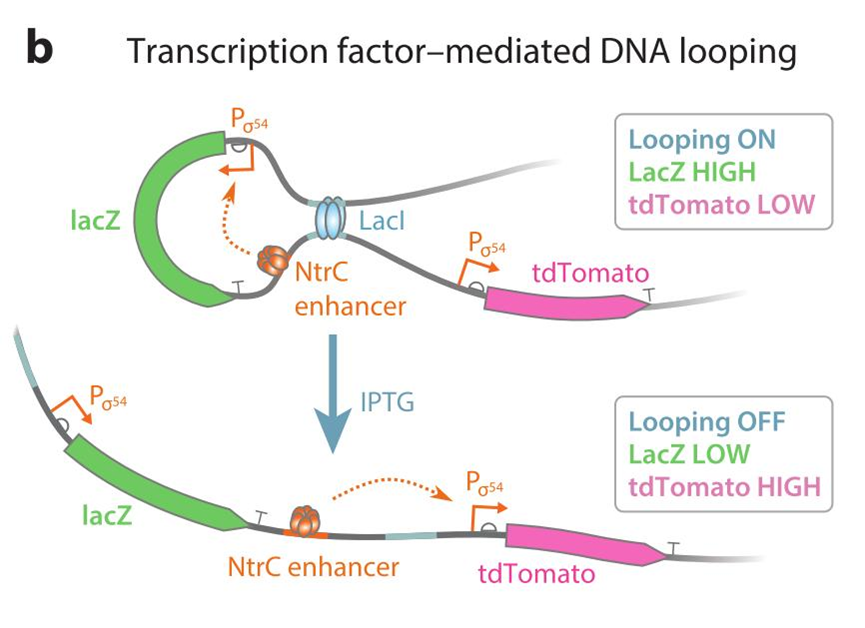
b:转录因子介导的 DNA 环:在lacZ和tdTomato基因上游均具有一段LacI 操纵序列,当 LacI 四聚体同时结合这两个操纵序列时会致使 DNA 弯曲形成环状并使得Ntrc增强子与lacZ基因启动子靠近并增强表达量。倘若经过 IPTG 诱导 LacI 蛋白失去阻遏作用则无法成环,Ntrc增强子优先增强下游tdTomato基因转录表达。
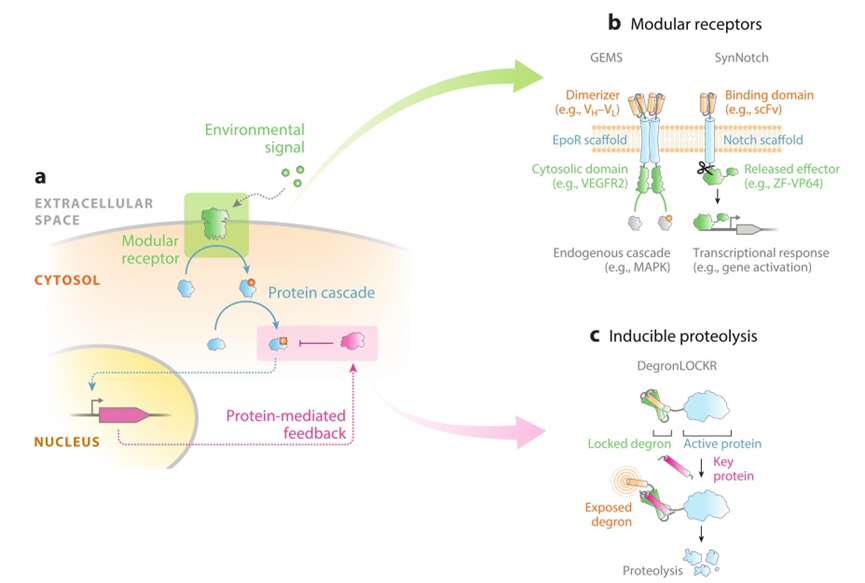
蛋白质-蛋白质相互作用:
a:环境中信号分子结合细胞膜表面分子受体,该受体磷酸化激活下游信号分子引发级联反应,最终效应分子进入细胞核调控基因表达,该基因表达产物蛋白负反馈抑制将要入核的效应分子(转录激活蛋白等)。
b:模块化设计组装受体结构,GEMS 和 SynNotch 中使用可定制的受体支架(EpoR、Notch 等),在此基础上定制并自由匹配组装输入(胞外受体结构域)和输出(胞浆信号转导激活)结构域。其中,下游反应结果可以是内源性途径的激活(磷酸化后的级联反应等),要么是合成效应物的释放,该效应物随后入核调控基因表达。
c:Degronlockr 是蛋白水解开关模块,同源关键蛋白的引入与该蛋白链接的标签结构域(degron)互作并触发暴露降解标签的螺旋位移,导致该蛋白被蛋白酶体特异性识别与降解。
04、总结和展望
The fourth part
第一代合成生物学始于Jacob和Monod概述的操纵子模型的理论范围内,并在生物噪声和自然基因调控网络的研究中发挥了重要作用。然而,自分子遗传学早期以来,研究者对基因表达调控的许多层面的基本理解已经急剧扩大,为新的调控策略和新部分的设计提供了信息。从这些跨越现代中心教条的工程努力中,一个普遍的主题浮现出来:历史上的分子工具越来越多地被模块化和可编程的生物分子所补充,这些生物分子可以连接各种合成系统和自然系统。
与此同时,作者探索生物多样性以寻找新活动和迅速重新利用现有工具的能力正在扩大可通过合成生物学控制的行为范围。随着基础研究和生物工程之间至关重要的相互作用的继续,作者预见了原核生物和真核生物合成生物学的新领域:配备了新的工具和更全面的生物学模型,合成生物学家可以将合成系统更无缝地整合到自然系统中,并最大限度地减少对宿主的不利影响。这对于需要工程细胞在实验室之外的长期稳定性和自主行为的应用尤为重要。
参考文献:[1] Monod J, Jacob F. 1961. General conclusions: teleonomic mechanisms in cellular metabolism, growth,and differentiation. Cold Spring Harb. Symp. Quant. Biol. 26:389–401