大家好!上一篇文章我们学习了Inside the atom相关知识,让我们继续跟着Hayley老师一起巩固Subatomic particles的内容吧!
1.Isotopes
同位素(Isotopes)是指同一元素的不同原子,其原子具有相同数目的质子,但中子数目却不同。
例如,碳-12、碳-13和碳-14是碳元素的三种同位素,质量数分别为12、13和14。碳的原子序数为6,这意味着每个碳原子有6个质子,因此这些同位素的中子数分别为6、7和8。
2.electronic structure
这里是Subatomic particles比较难的内容,讲的是原子核外电子的排布规律。首先我们要清楚,电子是在特定轨道上运动的,所以我们先来认识一下都有哪些轨道。
首先是电子层(shell),我们用1,2,3…表示,第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
举个例子,对6号元素碳来说,核外有6个电子,其排布便是:第一层有2个电子,剩下4个就填到第二层。
Shell还能细分,我们用s、p、d、f等符号分别表示各电子亚层(subshell),并在这些符号右上角用数字表示各亚层上电子的数目。(对应关系见手写笔记)
每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。无论是第几层,如果作为最外电子层时,那么这层的电子数不能超过8个,如果作为倒数第二层(次外层),那么这层的电子数便不能超过18个。
举个例子,如氧原子(8号元素)的电子排布式为1s²2s²2p⁴,钠原子(11号元素)的电子排布式为1s²2s²2p63s1
Shell与subshell的关系我们在手写笔记中做了归纳,同学们一定要熟悉,这里是考试的关键!
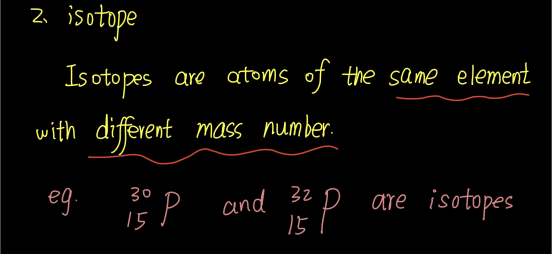

这部分知识对学生的记忆力和思考逻辑有较高的要求,对于一些学生来说比较困难,从而导致失分。下一篇内容中Hayley老师将带大家继续学习原子核外电子的排布规律!